
Медь и ее соединения
Учитель МБОУ лицея №64
Музыченко-Бакланова Г.Л.
г.Краснодар

Положение в Периодической системе
I группа, побочная подгруппа.
64 29 Cu
d-элемент
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1
Степени окисления +1, +2

Физические свойства меди.
Медь — металл розово-красного цвета, относится к группе тяжелых металлов, является отличным проводником тепла и электрического тока. Электропроводность меди в 1,7 раза выше, чем у алюминия, и в 6 раз выше, чем у железа.

Химические свойства меди.
Медь — малоактивный металл, в электрохимическом ряду напряжений она стоит правее водорода.
1.Окисление во влажном воздухе
2Cu + Н 2 О + O 2 + CO 2 = (CuOH) 2 CO 3
2. Медь реагирует с галогенами при нагревании
Cu + Cl 2 = CuCl 2
3. При сплавлении меди с серой образуетcя нерастворимый
в воде сульфид
2Cu + S = Cu 2 S
4. Взаимодействие с кислородом
4Cu + O 2 = 2Cu 2 O
2Cu + O 2 = 2CuO
t = 800
t = 400

Химические свойства меди.
5. В присутствии окислителей, прежде всего кислорода, медь реагирует с соляной и разбавленной серной кислотой, но водород при этом не выделяется:
2Cu + 4HCl + O 2 = 2CuCl 2 + 2H 2 O.
6. С азотной кислотой различных концентраций медь реагирует активно, при этом выделяются различные оксиды азота
3Cu + 8HNO 3 = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O.
7. С концентрированной серной кислотой медь реагирует при сильном нагревании:
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O.
8. Практическое значение имеет способность меди реагировать с растворами солей железа (III):
2FeCl 3 + Cu = CuCl 2 + 2FeCl 2
![Соединения меди Оксид меди (I) Cu2O – красновато-коричневые кристаллы 1.В воде не растворяется и не реагирует с ней. Имеет слабовыраженные амфотерные свойства с преобладанием основных. 2.Взаимодействует с растворами щелочей с образованием гидроксокомплексов: Cu 2 O + 2NaOH + H 2 O = 2Na[Cu(OH) 2 ]. 3.В водных растворах аммиака образует гидроксид диамминмеди (I): Cu 2 O + 4NH 3 + H 2 O = 2[Cu(NH 3 ) 2 ]OH. 4.С соляной кислотой взаимодействует с образованием дихлорокупрата (I) водорода: Cu 2 O + 4HCl = 2H[CuCl 2 ] + H 2 O.](https://img.vseuchi.ru/4/19/122433-de7u_6.jpg)
Соединения меди
Оксид меди (I)
Cu2O – красновато-коричневые кристаллы
1.В воде не растворяется и не реагирует с ней. Имеет слабовыраженные амфотерные свойства с преобладанием основных.
2.Взаимодействует с растворами щелочей с образованием гидроксокомплексов:
Cu 2 O + 2NaOH + H 2 O = 2Na[Cu(OH) 2 ].
3.В водных растворах аммиака образует гидроксид диамминмеди (I):
Cu 2 O + 4NH 3 + H 2 O = 2[Cu(NH 3 ) 2 ]OH.
4.С соляной кислотой взаимодействует с образованием дихлорокупрата (I) водорода:
Cu 2 O + 4HCl = 2H[CuCl 2 ] + H 2 O.

Соединения меди(+1)
окислитель
Cu 2 +1 O + CO = 2Cu 0 + CO 2
Cu +1 + 1e Cu 0
диспропорционирование
Cu 2 +1 O = Cu +2 O + Cu 0
восстановитель
4Cu +1 CL + O 2 + 4HCL = 4Cu +2 CL 2 + 2H 2 O
Cu +1 — 1e Cu +2
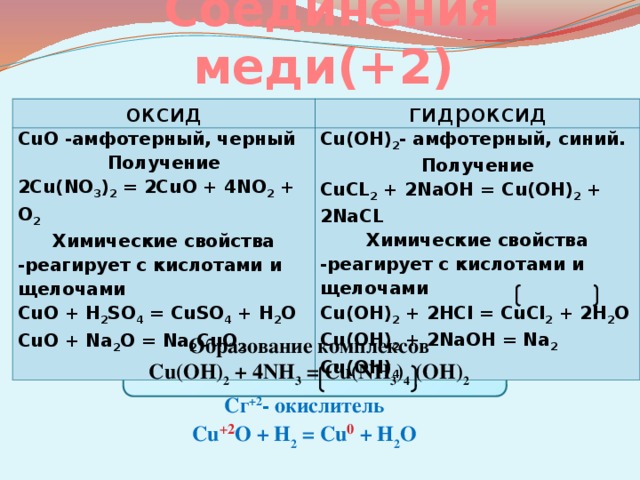
Соединения меди(+2)
оксид
гидроксид
CuO -амфотерный, черный
Получение
Cu(OH) 2 — амфотерный, синий.
Получение
2Cu(NO 3 ) 2 = 2CuO + 4NO 2 + O 2
Химические свойства
CuCL 2 + 2NaOH = Cu(OH) 2 + 2NaCL
-реагирует с кислотами и щелочами
Химические свойства
-реагирует с кислотами и щелочами
CuO + H 2 SO 4 = CuSO 4 + H 2 O
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O
CuO + Na 2 O = Na 2 CuO 2
Cu(OH) 2 + 2NaOH = Na 2 Cu(OH) 4
Образование комплексов
Cu(OH) 2 + 4NH 3 = Cu(NH 3 ) 4 (OH) 2
Сг +2 — окислитель
Cu +2 O + H 2 = Cu 0 + H 2 O

Область применения меди
Сплав меди, известный с древнейших времен, — бронза — содержит 4—30% олова (обычно 8—10%). Интересно, что бронза по своей твердости превосходит отдельно взятые чистые медь и олово.
Из бронзы отливали в средние века орудия и многие другие изделия. Знаменитые Царь-пушка и Царь-колокол в Московском Кремле также отлиты из сплава меди с оловом.

Домашнее задание — выучить изученную тему, — к ОВР(изученных в классе) составить электронный баланс, — записать уравнения реакций обмена с участием солей меди(II) в молекулярном, ионном видах; 2-е задание (индивидуальное) — подготовить слайд-презентацию о нахождении меди в природе, применении меди, ее соединений, сплавы меди, получение, медь в организме человека.